فرمول رایگان ساخت سرکه به روش صنعتی |
فرمول رایگان ساخت سرکه به روش صنعتی |
_ اسید کربوکسیلیک
_ استات
_ کلروفرم
_ پروپیل استات
تولید کنندگان گرامی : تولید سرکه به روش صنعتی کار بسیار آسانی می باشد.به مطالب فوق اهمیت ندهید.فرمول آسان و کاربردی تولید سرکه به روش صنعتی نزد ماست.با کمترین امکانات تولید کننده سرکه شوید.
_ فرمولاسیون رایگان تولید سرکه | _ آموزش ساخت اسیداستیک | _ نحوه تولید سرکه به روش کارخانه
مجانی |
______________________________
« شرکت ویلاتوس با افتخار اعلام مینماید آماده ارائه ی فرمولاسیون تولید انواع ؛
* انواع مواد غذایی (سرکه | کلودیفایر | بیکینگ پودر / انواع کنسرو / رب / مربا / و.....خوراک دام و طیور ) محصولات آرایشی و بهداشتی با بالاترین کیفیت و قابل رقابت با محصولات موجود در بازار به شما عزیزان میباشد.ما با مهندسین مجرب و زبده به شما آموزش میدهیم چگونه محصولی با کیفیت عالی و باصرفه اقتصادی بالا را تولید نمایید.
* محصولات شیمیایی و پتروشیمی مانند 《 انواع تینر / روغنی/ فوری و ...../ بی بو سازی گازوئیل / رنگ نیم پلاستیک / تمام پلاستیک و..... / حلال ها / بی رنگ کردن گازوئیل / بوزدایی و بی رنگ سازی نفت ، بنزین 》
* محصولات خودرویی /پوشش سرامیکی خودروها | باتری/ پودر آتشنشانی/ مواد اولیه تولید شوینده ( اسید سولفونیک/ تگزاپون ) / اسید باتری / شیمیایی / رزین ها / پتروشیمی / وارنیش/ ژل آتش زا/ تینر ها ضد زنگ و......صدها محصول دیگر
* محصولات ساختماني اعم از [عایق نانو ( ضد حرارت / صدا ) ، انواع بتونه ، بتونه سنگ/ کناف و.... | فوم سیمان | سنگ مصنوعی | فوم بتن و بتن | ] و .... ده ها محصول دیگر .
* محصولات شوینده نظیر [ شامپوفرش | پودر ماشین لباسشویی( سبک و سنگین ) /صابون رختشویی / قرص بوگیر دستشویی/ مایع گاز پاکن/ انواع شامپو/ مایع ظرفشویی و دستشویی/ سفید کننده و....... محصولات شوینده صنعتی مانند : شامپو کارواش/ دوراکلین / واکس داشبورد و بدنه و......ده ها محصول دیگر]
* محصولات آرایشی نظیر [ کانسیلر | تالک | تونر پاکن | بالم لب | برق لب | پودر دکلره | روشن کننده مو / افتر شیو/ کرم ضد آفتاب / مرطوب کننده/ آبرسان ژل مو _ چسب مژه _ چسب پروتز _ انواع رنگ مو _ پودر دکلره _ عطر مو _ میست مو _ بادی اسپلش _ انواع رژ گونه ( پودری _ ژل _ مایع _ براق _ مات ) _انواع کرم پودر _ مرطوب کننده _ ضد آفتاب _ رژ لب های مایع ، جامد ، مدادی _ ریمل _ خط چشم _ تافت ( اسپری و لاک مو ] و........ده ها محصول دیگر.
* چسب ها اعم از 《 چسب m / ممبران/ چسب چوب / چسب نساجی / چسب صحافي/ چسب کاغذ دیواری/ چسب سلفون و ........ده ها نوع چسب دیگر
پس از کیفیت عالی محصول مهمترین عامل برای تولید کننده قیمت تمام شده محصول است ؛ پس با کیفیت ترین فرمول و با صرفه اقتصادی بالا را تنها از ما بخواهید.
* ما با پشتیبانی یکساله به عنوان مشاور در کنار شما خواهیم بود.
جهت دریافت فرمولاسیون و مشاوره با در تماس باشید.»
______________________________
_ اسید استیک / سرکه |
این محصول با نام سیستماتیک [ اتانوئیک اسید ] یک مایع اسیدی، بی رنگ و آلی با فرمول شیمیایی CH3COOH (همچنین به عنوان CH3CO2H، C2H2H3O2، یا 2 نوشته می شود) است.
_ سرکه دارای حداقل 4 درصد حجمی اسید استیک است که اسید استیک را جدا از آب و سایر عناصر کمیاب، جزء اصلی سرکه می کند.
اسید استیک دومین اسید کربوکسیلیک ساده (بعد از اسید فرمیک) است.
این یک معرف شیمیایی مهم و یک ماده شیمیایی صنعتی است که عمدتاً در تولید استات سلولز برای فیلمهای عکاسی، پلی وینیل استات برای چسب چوب و الیاف و پارچههای مصنوعی استفاده میشود.
در خانوادهها، اسید استیک رقیق شده اغلب در مواد رسوبزدا استفاده میشود.
_ در صنایع غذایی، اسید استیک بهعنوان یک تنظیمکننده اسیدیته و بهعنوان چاشنی با کد افزودنی غذایی E260 کنترل میشود.
در بیوشیمی، گروه استیل، مشتق شده از اسید استیک، برای همه اشکال حیات اساسی است.
هنگامی که به کوآنزیم A متصل می شود، در متابولیسم کربوهیدرات ها و چربی ها نقش اساسی دارد.
_ تقاضای جهانی برای اسید استیک حدود 6.5 میلیون تن متریک در سال است که تقریباً 1.5 تن در هر سال از طریق بازیافت تامین می شود.
باقیمانده از متانول تولید میشود.
سرکه عمدتاً اسید استیک رقیق است که اغلب از طریق تخمیر و اکسیداسیون بعدی اتانول تولید میشود.
نام بی اهمیت «اسید استیک» رایج ترین و ترجیح داده شده ترین نام IUPAC است.
نام سیستماتیک "اتانوئیک اسید"، یک نام معتبر IUPAC، بر اساس نامگذاری جایگزین ساخته شده است.
نام "اسید استیک" از "acetum"، کلمه لاتین برای سرکه گرفته شده است و با خود کلمه "اسید" مرتبط است.
"اسید استیک یخبندان" نامی برای اسید استیک بدون آب (بی آب) است.
مشابه نام آلمانی "Eisessig" ("سرکه یخ")، این نام از کریستال های یخ مانندی گرفته شده است که کمی زیر دمای اتاق در 16.6 درجه سانتیگراد (61.9 درجه فارنهایت) تشکیل می شوند (وجود 0.1٪ آب نقطه ذوب آن را کاهش می دهد. 0.2 درجه سانتیگراد).
_ یک نماد رایج برای اسید استیک AcOH است که Ac نماد شبه عنصری است که گروه استیل CH3−C(=O)- را نشان میدهد.
بنابراین، پایه مزدوج، استات (CH3COO-)، به عنوان AcO- نشان داده می شود.
(نماد Ac برای گروه عاملی استیل نباید با نماد Ac برای عنصر اکتینیوم اشتباه گرفته شود؛ زمینه از سردرگمی در بین شیمیدانان آلی جلوگیری می کند).
برای انعکاس بهتر ساختار آن، اسید استیک اغلب به صورت CH3-C(O)OH، CH3-C(=O)OH، CH3COOH و CH3CO2H نوشته می شود.
در زمینه واکنشهای اسید-باز، گاهی اوقات از مخفف HAc استفاده میشود، که Ac در این مورد نمادی برای استات است (به جای استیل).
استات یونی است که در نتیجه از دست دادن H+ از اسید استیک به وجود میآید.
نام «استات» همچنین میتواند به نمک حاوی این آنیون یا استر اسید استیک اشاره داشته باشد.
__________________________________________
_اسیدیته |
مرکز هیدروژن در گروه کربوکسیل (-COOH) در اسیدهای کربوکسیلیک مانند اسید استیک می تواند با یونیزاسیون از مولکول جدا شود:
CH3COOH ⇌ CH3CO−2 + H+
به دلیل انتشار پروتون (H+)، اسید استیک ویژگی اسیدی دارد.
اسید استیک یک اسید مونوپروتیک ضعیف است. در محلول آبی، مقدار pKa آن 4.76 است.
پایه مزدوج آن استات است (CH3COO-). یک محلول 1.0 M (در حدود غلظت سرکه خانگی) دارای pH 2.4 است که نشان میدهد فقط 0.4 درصد از مولکولهای اسید استیک جدا شدهاند.
با این حال، در محلول بسیار رقیق (< 10-6 M) اسید استیک بیش از 90٪ تجزیه می شود.
StructureEdit
_ در اسید استیک جامد، مولکولها زنجیرهها را تشکیل میدهند، مولکولهای جداگانه با پیوندهای هیدروژنی به هم متصل میشوند.
در بخار 120 درجه سانتیگراد (248 درجه فارنهایت)، دایمرها قابل شناسایی هستند.
دایمرها همچنین در فاز مایع در محلولهای رقیق در حلالهای غیر پیوندی هیدروژنی و تا حدی در اسید استیک خالص وجود دارند، اما توسط حلالهای پیوند هیدروژنی مختل میشوند. آنتالپی تفکیک دایمر 65.0-66.0 کیلوژول بر مول، و آنتروپی تفکیک در 154-157 J mol-1 K-1 برآورد شده است.
سایر اسیدهای کربوکسیلیک در تعاملات پیوند هیدروژنی بین مولکولی مشابه شرکت می کنند.
_خواص حلال
اسید استیک مایع یک حلال پروتیک آبدوست (قطبی) شبیه به اتانول و آب است.
با گذردهی نسبی استاتیک (ثابت دی الکتریک) 6.2، نه تنها ترکیبات قطبی مانند نمک های معدنی و قندها، بلکه ترکیبات غیر قطبی مانند روغن ها و همچنین املاح قطبی را نیز حل می کند.
با حلال های قطبی و غیر قطبی مانند آب، کلروفرم و هگزان قابل اختلاط است. با آلکانهای بالاتر (با اکتان شروع میشود)، اسید استیک در همه ترکیبها قابل اختلاط نیست و حلالیت اسید استیک در آلکانها با n-آلکانهای طولانیتر کاهش مییابد.
خواص حلال و امتزاج پذیری اسید استیک آن را به یک ماده شیمیایی صنعتی مفید تبدیل می کند، به عنوان مثال، به عنوان حلال در تولید دی متیل ترفتالات.
_Biochemistry
در pH های فیزیولوژیکی، اسید استیک معمولاً به طور کامل به استات یونیزه می شود.
_ گروه استیل، که به طور رسمی از اسید استیک مشتق شده است، برای همه اشکال حیات اساسی است.
هنگامی که به کوآنزیم A متصل می شود، در متابولیسم کربوهیدرات ها و چربی ها نقش اساسی دارد.
برخلاف اسیدهای کربوکسیلیک با زنجیره بلندتر (اسیدهای چرب)، اسید استیک در تری گلیسیریدهای طبیعی وجود ندارد.
با این حال، تری گلیسیرید مصنوعی تری استین (گلیسیرین تری استات) یک افزودنی رایج غذایی است و در لوازم آرایشی و داروهای موضعی یافت میشود.
_ اسید استیک توسط باکتریهای اسید استیک، بهویژه جنس استوباکتر و کلستریدیوم استوبوتیلیکوم تولید و دفع میشود.
این باکتریها به طور کلی در مواد غذایی، آب و خاک یافت میشوند و اسید استیک بهطور طبیعی با فاسد شدن میوهها و سایر غذاها تولید میشود.
اسید استیک همچنین جزئی از روانکاری واژن انسان و سایر پستانداران است، جایی که به نظر می رسد به عنوان یک عامل ضد باکتری خفیف عمل می کند.
اسید استیک به صورت صنعتی هم به صورت مصنوعی و هم از طریق تخمیر باکتریایی تولید می شود.
حدود 75 درصد از اسید استیک ساخته شده برای استفاده در صنایع شیمیایی توسط کربونیلاسیون متانول ساخته می شود که در زیر توضیح داده شده است.
مسیر بیولوژیکی تنها حدود 10 درصد از تولید جهانی را تشکیل می دهد، اما برای تولید سرکه همچنان مهم است، زیرا بسیاری از قوانین خلوص مواد غذایی، سرکه مورد استفاده در غذاها را ملزم می کنند که منشاء بیولوژیکی داشته باشد. فرآیندهای دیگر عبارتند از ایزومریزاسیون متیل فرمات، تبدیل گاز سنتز به اسید استیک و اکسیداسیون فاز گاز اتیلن و اتانول.
اسید استیک اغلب محصول جانبی واکنش های مختلف است، به عنوان مثال. در طول سنتز اسید اکریلیک کاتالیزوری ناهمگن یا تولید اسید لاکتیک تخمیری.
اسید استیک را می توان از طریق انجماد جزئی با استفاده از حمام یخ خالص کرد.
آب و سایر ناخالصیها مایع باقی میمانند در حالی که اسید استیک رسوب میکند.
از سال 2003 تا 2005، کل تولید جهانی اسید استیک بکر، 5 میلیون تن در هر سال (میلیون تن در سال) تخمین زده شد که تقریباً نیمی از آن در ایالات متحده تولید می شد. تولید اروپا تقریباً 1 میلیون تن در سال و رو به کاهش بود، در حالی که تولید ژاپن 0.7 میلیون تن در هر سال بود.
هر سال 1.5 میلیون تن دیگر بازیافت میشود و کل بازار جهانی را به 6.5 میلیون تن در هر سال میرساند.
از آن زمان تولید جهانی به 10.7 میلیون تن در هر سال (در سال 2010) افزایش یافته است.
با این حال، کاهش در این افزایش در تولید پیش بینی می شود.
دو بزرگترین تولید کننده اسید استیک بکر، Celanese و BP Chemicals هستند. سایر تولیدکنندگان عمده عبارتند از هزاره، شیمیایی استرلینگ، سامسونگ، ایستمن و اسونسک اتانولکمی.
_کربونیلاسیون متانول |
بیشتر اسید استیک از طریق کربنیلاسیون متانول تولید می شود.
در این فرآیند، متانول و مونوکسید کربن مطابق با معادله زیر واکنش نشان میدهند تا اسید استیک تولید کنند:
_ این فرآیند شامل یدومتان به عنوان یک واسطه است و در سه مرحله انجام میشود.
یک کاتالیزور، کربونیل فلز، برای کربونیلاسیون مورد نیاز است .
CH3OH + HI → CH3I + H2O
CH3I + CO → CH3COI
CH3COI + H2O → CH3COOH + HI
دو فرآیند مرتبط برای کربونیلاسیون متانول وجود دارد: فرآیند مونسانتو کاتالیز شده با رودیوم و فرآیند کاتیوای کاتالیز شده با ایریدیوم.
فرآیند دوم سبزتر و کارآمدتر است و تا حد زیادی جایگزین فرآیند اول شده است، اغلب در همان کارخانههای تولید. مقادیر کاتالیزوری آب در هر دو فرآیند استفاده میشود، اما فرآیند کاتیوا به کمتری نیاز دارد، بنابراین واکنش جابجایی آب-گاز سرکوب میشود و محصولات جانبی کمتری تشکیل میشوند.
با تغییر شرایط فرآیند، انیدرید استیک نیز ممکن است در همان کارخانه با استفاده از کاتالیزورهای رودیم تولید شود.
_اکسیداسیون استالدهید |
قبل از تجاریسازی فرآیند مونسانتو، بیشتر اسید استیک از طریق اکسیداسیون استالدئید تولید میشد.
این روش دومین روش تولید مهم است، اگرچه معمولاً با کربونیلاسیون متانول قابل رقابت نیست.
استالدهید را می توان با هیدراتاسیون استیلن تولید کرد. این فناوری غالب در اوایل دهه 1900 بود.
اجزای نفتای سبک به آسانی توسط اکسیژن یا حتی هوا اکسید می شوند و پراکسیدهایی تولید می کنند که تجزیه می شوند و طبق معادله شیمیایی که با بوتان نشان داده شده است، اسید استیک تولید می کنند:
2 C4H10 + 5 O2 → 4 CH3CO2H + 2 H2O
چنین اکسیداسیونهایی به کاتالیزور فلزی مانند نمکهای نفتنات منگنز، کبالت و کروم نیاز دارند.
واکنش معمولی در دماها و فشارهایی انجام میشود که تا حد ممکن گرم باشد و در عین حال بوتان را مایع نگه دارد. شرایط واکنش معمولی 150 درجه سانتیگراد (302 درجه فارنهایت) و 55 اتمسفر است.
محصولات جانبی نیز ممکن است تشکیل شوند، از جمله بوتانون، اتیل استات، اسید فرمیک و اسید پروپیونیک.
این محصولات جانبی از نظر تجاری نیز ارزشمند هستند و شرایط واکنش ممکن است برای تولید بیشتر آنها در صورت نیاز تغییر یابد.
با این حال، جداسازی اسید استیک از این محصولات جانبی به هزینه این فرآیند میافزاید.
_ تحت شرایط مشابه و با استفاده از کاتالیزورهای مشابهی که برای اکسیداسیون بوتان استفاده میشود، اکسیژن موجود در هوا برای تولید اسید استیک میتواند استالدئید را اکسید کند.
2 CH3CHO + O2 → 2 CH3CO2H
با استفاده از کاتالیزورهای مدرن، این واکنش می تواند بازده اسید استیک بیش از 95٪ داشته باشد.
محصولات جانبی اصلی اتیل استات، اسید فرمیک و فرمالدئید هستند که همگی نقطه جوش پایینتری نسبت به اسید استیک دارند و به آسانی با تقطیر جدا میشوند.
_اکسیداسیون اتیلن
استالدئید ممکن است از اتیلن از طریق فرآیند واکر تهیه شود و سپس مانند بالا اکسید شود.
در زمانهای اخیر، شرکت شیمیایی Showa Denko، که در سال 1997 یک کارخانه اکسیداسیون اتیلن را در اویتا، ژاپن افتتاح کرد، تبدیل تک مرحلهای ارزانتر اتیلن به اسید استیک را تجاری کرد.
این فرآیند توسط یک کاتالیزور فلزی پالادیوم که روی یک اسید هتروپلی مانند اسید سیلیکوتنگستیک پشتیبانی میشود، کاتالیز میشود.
فرآیند مشابهی از همان کاتالیزور فلزی روی اسید سیلیکوتنگستیک و سیلیس استفاده میکند:
C2H4 + O2 → CH3CO2H
تصور میشود که بسته به قیمت محلی اتیلن، با کربونیلاسیون متانول برای گیاهان کوچکتر (100 تا 250 کیلوتن در هکتار) رقابتی باشد.
این رویکرد مبتنی بر استفاده از یک فناوری جدید اکسیداسیون فوتوکاتالیستی انتخابی برای اکسیداسیون انتخابی اتیلن و اتان به اسید استیک خواهد بود.
برخلاف کاتالیزورهای اکسیداسیون سنتی، فرآیند اکسیداسیون انتخابی از نور UV برای تولید اسید استیک در دما و فشار محیط استفاده میکند.
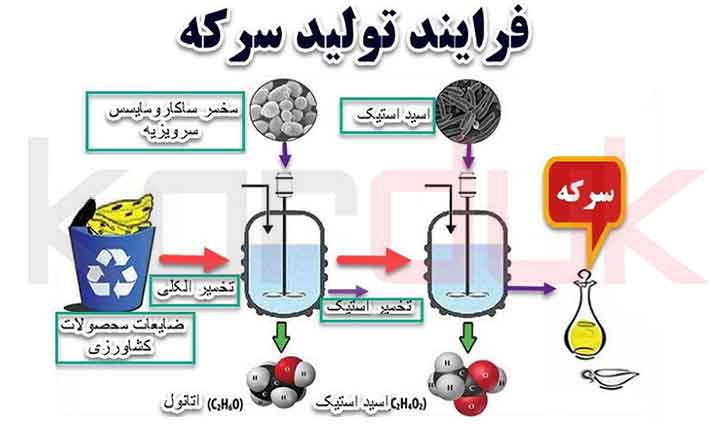
_تخمیر اکسیداتیو |
در بیشتر تاریخ بشر، باکتریهای اسید استیک از جنس استوباکتر، اسید استیک را به شکل سرکه ساختهاند.
با توجه به اکسیژن کافی، این باکتری ها می توانند از انواع مواد غذایی الکلی سرکه تولید کنند.
خوراکهای رایج شامل سیب، شراب، غلات تخمیر شده، مالت، برنج یا پوره سیبزمینی است.
واکنش شیمیایی کلی که توسط این باکتری ها تسهیل می شود عبارتند از:
C2H5OH + O2 → CH3COOH + H2O
محلول رقیق الکلی که با استوباکتر تلقیح شده و در مکانی گرم و هوا نگهداری شود، در طی چند ماه تبدیل به سرکه می شود.
روشهای تولید سرکه صنعتی با بهبود تامین اکسیژن به باکتریها، این فرآیند را تسریع میکنند.
اولین دستههای سرکه تولید شده از طریق تخمیر احتمالاً به دنبال اشتباهاتی در فرآیند شرابسازی بودند.
اگر باید در دمای خیلی بالا تخمیر شود، استوباکتر بر مخمر طبیعی موجود در انگور غلبه میکند.
با افزایش تقاضا برای سرکه برای مقاصد آشپزی، پزشکی و بهداشتی، باغداران به سرعت یاد گرفتند که از سایر مواد ارگانیک برای تولید سرکه در ماه های گرم تابستان قبل از رسیدن انگور و آماده شدن برای تبدیل شدن به شراب استفاده کنند.
با این حال، این روش کند بود و همیشه موفقیت آمیز نبود، زیرا تاک کاران این فرآیند را درک نمی کردند.
یکی از اولین فرآیندهای تجاری مدرن "روش سریع" یا "روش آلمانی" بود که برای اولین بار در سال 1823 در آلمان انجام شد.
در این فرآیند، تخمیر در برجی مملو از تراشه های چوب یا زغال چوب انجام می شود.
خوراک حاوی الکل به بالای برج چکانده میشود و هوای تازه از پایین با همرفت طبیعی یا اجباری تأمین میشود. بهبود عرضه هوا در این فرآیند زمان تهیه سرکه را از ماه ها به هفته ها کاهش داد.
__________________________________________
_ امروزه، بیشتر سرکه در کشت مخازن غوطهور ساخته میشود که اولین بار در سال 1949 توسط Otto Hromatka و Heinrich Ebner توصیف شد.
در این روش، الکل در یک مخزن به طور مداوم به سرکه تخمیر می شود و اکسیژن از طریق حباب هوا از طریق محلول تامین می شود.
با استفاده از کاربردهای مدرن این روش، سرکه 15 درصد اسید استیک را می توان تنها در 24 ساعت در فرآیند ناپیوسته، حتی 20 درصد در فرآیند تغذیه-بچ 60 ساعته تهیه کرد.
_تخمیر بی هوازی |
گونههایی از باکتریهای بیهوازی، از جمله اعضای جنس کلستریدیوم یا استوباکتریوم، میتوانند قندها را مستقیماً بدون ایجاد اتانول بهعنوان واسطه، به اسید استیک تبدیل کنند.
واکنش شیمیایی کلی انجام شده توسط این باکتری ها ممکن است به صورت زیر نمایش داده شود:
C6H12O6 → 3 CH3COOH
این باکتریهای استوژنیک اسید استیک را از ترکیبات تک کربنی، از جمله متانول، مونوکسید کربن یا مخلوطی از دیاکسید کربن و هیدروژن تولید میکنند:
2 CO2 + 4 H2 → CH3COOH + 2 H2O
این توانایی کلستریدیوم برای متابولیسم مستقیم قندها یا تولید اسید استیک از ورودیهای کمهزینه، نشان میدهد که این باکتریها میتوانند اسید استیک را کارآمدتر از اکسیدکنندههای اتانول مانند استوباکتر تولید کنند.
با این حال، باکتریهای کلستریدیوم نسبت به استوباکتر نسبت به اسید مقاومتر هستند.
حتی مقاومترین سویههای کلستریدیوم میتوانند سرکه را در غلظتهای چند درصد تولید کنند، در مقایسه با سویههای استوباکتر که میتوانند در غلظتهای تا ۲۰ درصد سرکه تولید کنند.
در حال حاضر، تولید سرکه با استفاده از استوباکتر به جای استفاده از کلستریدیوم و تغلیظ آن مقرون به صرفهتر است. در نتیجه، اگرچه باکتریهای استوژن از سال 1940 شناخته شدهاند، اما استفاده صنعتی از آنها به چند کاربرد خاص محدود میشود.
[ اسید استیک ] یک معرف شیمیایی برای تولید ترکیبات شیمیایی است.
بزرگترین استفاده منفرد از اسید استیک در تولید مونومر وینیل استات است و پس از آن استیک انیدرید و استر تولید می شود.
حجم اسید استیک مورد استفاده در سرکه نسبتاً کم است.
_مونومر وینیل استات |
استفاده اولیه از اسید استیک تولید مونومر وینیل استات (VAM) است.
در سال 2008، تخمین زده شد که این برنامه یک سوم تولید اسید استیک در جهان را مصرف کند.
این واکنش شامل اتیلن و اسید استیک با اکسیژن روی یک کاتالیزور پالادیوم است که در فاز گاز انجام میشود.
2 H3C-COOH + 2 C2H4 + O2 → 2 H3C-CO-O-CH=CH2 + 2 H2O
وینیل استات را می توان به پلی وینیل استات یا سایر پلیمرها، که اجزایی در رنگ ها و چسب ها هستند، پلیمریزه کرد.
_تولید استر |
استرهای اصلی اسید استیک معمولاً به عنوان حلال برای جوهرها، رنگها و پوششها استفاده میشوند.
استرها شامل اتیل استات، n-بوتیل استات، ایزوبوتیل استات و پروپیل استات هستند.
آنها معمولاً با واکنش کاتالیز شده از اسید استیک و الکل مربوطه تولید می شوند:
CH3COO−H + HO−R → CH3COO−R + H2O، R =
_گروه آلکیل عمومی
به عنوان مثال، اسید استیک و اتانول به اتیل استات و آب میدهند.
CH3COO−H + HO−CH2CH3 → CH3COO−CH2CH3 + H2O
با این حال، بیشتر استرهای استات از استالدئید با استفاده از واکنش تیشچنکو تولید میشوند.
علاوه بر این، استاتهای اتر به عنوان حلال برای نیتروسلولز، لاکهای اکریلیک، پاککننده لاک و لکههای چوب استفاده میشوند.
ابتدا مونو اترهای گلیکول از اکسید اتیلن یا پروپیلن اکسید با الکل تولید میشوند که سپس با اسید استیک استری میشوند. سه محصول اصلی عبارتند از اتیلن گلیکول مونو اتیل اتر استات (EEA)، اتیلن گلیکول مونوبوتیل اتر استات (EBA) و پروپیلن گلیکول مونو متیل اتر استات (PMA، که بیشتر به عنوان PGMEA در فرآیندهای تولید نیمه هادی شناخته می شود، جایی که به عنوان یک حلال مقاوم استفاده می شود. ).
این نرم افزار حدود 15 تا 20 درصد از اسید استیک در سراسر جهان را مصرف می کند.
استات های اتر، برای مثال EEA، برای تولید مثل انسان مضر هستند.[30]
_انیدرید استیک |
محصول تراکم دو مولکول اسید استیک انیدرید استیک است. تولید جهانی انیدرید استیک یک کاربرد عمده است و تقریباً از 25 تا 30 درصد تولید جهانی اسید استیک استفاده می شود.
فرآیند اصلی شامل آبگیری اسید استیک برای دادن کتن در دمای 700 تا 750 درجه سانتیگراد است.
سپس کتن با اسید استیک برای به دست آوردن انیدرید واکنش داده می شود:
CH3CO2H → CH2=C=O + H2OCH3CO2H + CH2=C=O → (CH3CO)2O
انیدرید استیک یک عامل استیلاسیون است.
به این ترتیب، کاربرد اصلی آن برای استات سلولز است، یک نساجی مصنوعی که برای فیلمهای عکاسی نیز استفاده میشود.
انیدرید استیک نیز یک معرف برای تولید هروئین و سایر ترکیبات است.
_استفاده به عنوان حلال |
همانطور که در بالا ذکر شد، اسید استیک گلاسیال یک حلال پروتیک قطبی عالی است.
اغلب به عنوان یک حلال برای تبلور مجدد برای خالص سازی ترکیبات آلی استفاده می شود.
اسید استیک به عنوان یک حلال در تولید [ ترفتالیک اسید (TPA) ] ، ماده اولیه پلی اتیلن ترفتالات (PET) استفاده میشود.
در سال 2006، حدود 20 درصد از اسید استیک برای تولید TPA استفاده شد.
_ اسید استیک اغلب بهعنوان حلال برای واکنشهای مربوط به کربوکاتیونها، مانند آلکیلاسیون فریدل کرافت استفاده میشود.
برای مثال، یک مرحله در تولید تجاری کامفور مصنوعی شامل بازآرایی واگنر-میروین از کامفن به ایزوبورنیل استات است.
در اینجا اسید استیک هم به عنوان یک حلال و هم به عنوان یک هسته دوست برای به دام انداختن کربوکاتیون بازآرایی شده عمل می کند.
_ اسید استیک یخبندان در شیمی تجزیه برای تخمین مواد قلیایی ضعیف مانند آمیدهای آلی استفاده می شود.
اسید استیک یخبندان باز بسیار ضعیفتر از آب است، بنابراین آمید در این محیط مانند یک باز قوی عمل میکند.
سپس میتوان آن را با استفاده از محلولی در اسید استیک یخچالی از یک اسید بسیار قوی، مانند اسید پرکلریک، تیتر کرد.
_استفاده پزشکی
تزریق اسید استیک به تومور از دهه 1800 برای درمان سرطان استفاده شده است.
اسید استیک به عنوان بخشی از غربالگری سرطان دهانه رحم در بسیاری از مناطق در جهان در حال توسعه استفاده میشود.
اسید روی دهانه رحم اعمال میشود و اگر بعد از حدود یک دقیقه ناحیه سفید ظاهر شود، آزمایش مثبت است.
اسید استیک یک ضد عفونی کننده موثر است که به عنوان یک محلول 1٪ استفاده شود، با طیف وسیعی از فعالیت علیه استرپتوکوک، استافیلوکوک، سودوموناس، انتروکوک و دیگران.
ممکن است برای درمان عفونت های پوستی ناشی از سویه های سودوموناس مقاوم به آنتی بیوتیک های معمولی استفاده شود.
_ در حالی که اسید استیک رقیق شده در یونتوفورز استفاده میشود، هیچ شواهدی با کیفیت بالا از این درمان برای بیماری روتاتور کاف پشتیبانی نمیکند.
به عنوان درمانی برای اوتیت خارجی، در فهرست داروهای ضروری سازمان بهداشت جهانی قرار دارد.
اسید استیک 349 کیلوکالری (1460 کیلوژول) در هر 100 گرم دارد.
سرکه معمولاً کمتر از 4 درصد جرمی اسید استیک است.
محدودیت های قانونی در مورد محتوای اسید استیک بسته به حوزه قضایی متفاوت است.
سرکه مستقیماً به عنوان چاشنی و در ترشی سبزیجات و سایر غذاها استفاده می شود.
سرکه سفره معمولاً رقیقتر (4 تا 8 درصد اسید استیک) است، در حالی که ترشیهای غذایی تجاری از محلولهایی استفاده میکنند که غلیظتر هستند.
نسبت اسید استیک که در سرتاسر جهان به عنوان سرکه استفاده می شود به اندازه مصارف تجاری نیست، اما قدیمی ترین و شناخته شده ترین کاربرد است.
اسید استیک تحت واکنشهای شیمیایی معمول یک اسید کربوکسیلیک قرار میگیرد.
پس از درمان با پایه استاندارد، به استات فلزی و آب تبدیل میشود.
با بازهای قوی (مثلاً معرفهای ارگانولیتیوم)، میتوان آن را دوبرابر پروتون زدایی کرد و LiCH2COOLi ایجاد کرد. کاهش اسید استیک اتانول می دهد.
گروه OH محل اصلی واکنش است، همانطور که با تبدیل اسید استیک به استیل کلرید نشان داده شده است.
سایر مشتقات جایگزین عبارتند از انیدرید استیک. این انیدرید با از دست دادن آب از دو مولکول اسید استیک تولید می شود.
استرهای اسید استیک نیز میتوانند از طریق استریفیکیشن فیشر و آمیدها تشکیل شوند.
هنگامی که در دمای بالای 440 درجه سانتیگراد (824 درجه فارنهایت) گرم می شود، اسید استیک برای تولید دی اکسید کربن و متان یا تولید کتن و آب تجزیه می شود:
CH3COOH → CH4 + CO2CH3COOH → CH2=C=O + H2O
_واکنش با ترکیبات معدنی
اسید استیک برای فلزات از جمله آهن، منیزیم و روی خورنده خفیف است و گاز هیدروژن و نمک هایی به نام استات را تشکیل می دهد:
Mg + 2 CH3COOH → (CH3COO) 2Mg + H2
از آنجایی که آلومینیوم یک فیلم غیرفعال کننده مقاوم در برابر اسید از اکسید آلومینیوم تشکیل می دهد، از مخازن آلومینیومی برای انتقال اسید استیک استفاده می شود. استاتهای فلزی را میتوان از اسید استیک و یک پایه مناسب نیز تهیه کرد، مانند واکنش محبوب «جوش شیرین + سرکه» که استات سدیم را تولید میکند:
NaHCO3 + CH3COOH → CH3COONa + CO2 + H2O
_ یک واکنش رنگی برای نمک های اسید استیک محلول کلرید آهن (III) است که منجر به رنگ قرمز عمیقی می شود که پس از اسیدی شدن ناپدید می شود.
یک آزمایش حساس تر از نیترات لانتانیم با ید و آمونیاک برای ایجاد محلول آبی استفاده می کند.
استاتها وقتی با تریاکسید آرسنیک گرم میشوند، اکسید کاکودیل را تشکیل میدهند که میتوان آن را با بخارات بدبو آن تشخیص داد.
_سایر مشتقات
نمک های آلی یا معدنی از اسید استیک تولید می شوند. برخی از مشتقات تجاری مهم:
●استات سدیم، مورد استفاده در صنعت نساجی و به عنوان نگهدارنده مواد غذایی (E262).
● استات مس (II) که به عنوان رنگدانه و قارچ کش استفاده می شود.
●استات آلومینیوم و استات آهن (II) - به عنوان مادهی خنثی برای رنگها استفاده میشود.
● استات پالادیوم (II)، به عنوان کاتالیزور برای واکنش های جفت آلی مانند واکنش هک استفاده می شود.
● اسیدهای استیک هالوژنه از اسید استیک تولید می شوند. برخی از مشتقات تجاری مهم:
● اسید کلرواستیک (مونوکلرواستیک اسید، MCA)، دی کلرواستیک اسید (که یک محصول جانبی در نظر گرفته میشود) و اسید تری کلرواستیک. MCA در ساخت رنگ نیلی استفاده می شود.
●اسید برومواستیک که برای تولید معرف اتیل برمواستات استری شده است.
● تری فلورواستیک اسید، که یک معرف رایج در سنتز آلی است.
_مقادیر اسید استیک مورد استفاده در این کاربردهای دیگر با هم 5 تا 10 درصد دیگر مصرف اسید استیک در سراسر جهان را تشکیل می دهند.
__________________________________________
_ تاریخچه |
سرکه در اوایل تمدن به عنوان نتیجه طبیعی قرار گرفتن در معرض آبجو و شراب در هوا شناخته میشد، زیرا باکتریهای تولیدکننده اسید استیک در سطح جهانی وجود دارند. استفاده از اسید استیک در کیمیاگری به قرن سوم قبل از میلاد ادامه مییابد، زمانی که فیلسوف یونانی تئوفراستوس توضیح داد که چگونه سرکه روی فلزات برای تولید رنگدانههای مفید در هنر، از جمله سرب سفید (کربنات سرب) و وردیگریس، مخلوط سبز نمکهای مس از جمله مس، عمل میکند. (II) استات.
_رومیان باستان شراب ترش را می جوشاندند تا شربتی بسیار شیرین به نام ساپا تولید کنند.
ساپا که در گلدانهای سربی تولید میشد سرشار از استات سرب بود، مادهای شیرین که به آن قند سرب یا قند زحل نیز میگویند، که در مسمومیت با سرب در میان اشراف رومی نقش داشت.
در قرن شانزدهم، آندریاس لیباویوس، کیمیاگر آلمانی، تولید استون از تقطیر خشک استات سرب، دکربوکسیلاسیون کتونیک را توصیف کرد.
وجود آب در سرکه چنان تأثیر عمیقی بر خواص اسید استیک دارد که برای قرن ها شیمیدانان معتقد بودند که اسید استیک یخچالی و اسید موجود در سرکه دو ماده متفاوت هستند.
شیمیدان فرانسوی پیر ادت ثابت کرد که آنها یکسان هستند.
در سال 1845، هرمان کولبه، شیمیدان آلمانی، برای اولین بار اسید استیک را از ترکیبات غیرآلی سنتز کرد.
این توالی واکنش شامل کلرزنی دی سولفید کربن به تتراکلرید کربن و به دنبال آن تجزیه در اثر حرارت به تتراکلرواتیلن و کلرزنی آبی به اسید تری کلرواستیک بود و با احیای الکترولیتی به اسید استیک به پایان رسید.
_ تا سال 1910، بیشتر اسید استیک یخبندان از مشروب پیرولین، محصولی از تقطیر چوب، به دست میآمد.
اسید استیک با تیمار شیر آهک جدا شد و استات کلسیم به دست آمده برای بازیابی اسید استیک با اسید سولفوریک اسیدی شد.
در آن زمان، آلمان 10000 تن اسید استیک یخچالی تولید میکرد که حدود 30 درصد آن برای تولید رنگ نیل استفاده میشد.
از آنجایی که هم [ متانول و هم مونوکسید کربن] مواد خام کالا هستند، کربونیلاسیون متانول مدتها پیشسازهای جذابی برای اسید استیک به نظر میرسید.
هنری دریفوس در بریتیش سلانیز یک کارخانه آزمایشی کربونیلاسیون متانول را در اوایل سال 1925 توسعه داد.
با این حال، فقدان مواد عملی که بتواند مخلوط واکنش خورنده را در فشارهای بالا مورد نیاز (200 اتمسفر یا بیشتر) در خود داشته باشد، از تجاریسازی این مسیرها جلوگیری کرد.
اولین فرآیند تجاری کربونیلاسیون متانول، که از یک کاتالیزور کبالت استفاده می کرد، توسط شرکت شیمیایی آلمانی BASF در سال 1963 توسعه یافت.
در سال 1968، یک کاتالیزور مبتنی بر رودیوم (cis-[Rh(CO)2I2]-) کشف شد که می توانست به طور موثر در فشار کمتر و تقریباً بدون هیچ محصول جانبی. شرکت شیمیایی ایالات متحده شرکت مونسانتو اولین کارخانه را با استفاده از این کاتالیزور در سال 1970 ساخت و کربونیلاسیون متانول کاتالیز شده با رودیوم به روش غالب تولید اسید استیک تبدیل شد (به فرآیند مونسانتو مراجعه کنید ...)
_ در اواخر دهه 1990، شرکت شیمیایی BP Chemicals کاتالیزور کاتیو ([Ir(CO)2I2]- را تجاری کرد، که توسط ایریدیوم برای کارایی بیشتر تبلیغ میشود.
_ این فرآیند کاتیوای کاتالیز شده با ایریدیوم، سبزتر و کارآمدتر است و تا حد زیادی جایگزین فرآیند مونسانتو شده است، اغلب در همان کارخانههای تولید.
اسید استیک بین ستارهای در سال 1996 توسط تیمی به رهبری دیوید مهرینگر با استفاده از آرایه انجمن سابق برکلی-ایلینوی-مریلند در رصدخانه رادیویی هات کریک و آرایه میلیمتری سابق واقع در رصدخانه رادیویی دره اوونز کشف شد.
اولین بار در ابر مولکولی Sagittarius B2 North (همچنین به عنوان منبع Sgr B2 Large Molecule Heimat شناخته میشود) شناسایی شد.
اسید استیک اولین مولکولی است که در محیط بین ستاره ای تنها با استفاده از تداخل سنج های رادیویی کشف شد.
در تمام اکتشافات مولکولی ISM قبلی که در رژیمهای طول موج میلیمتری و سانتیمتری انجام شده بود، تلسکوپهای رادیویی منفرد حداقل تا حدی مسئول تشخیص بودند.
_اثرات بهداشتی و ایمنی |
اسید استیک غلیظ برای پوست خورنده است.
این سوختگی ها یا تاول ها ممکن است تا چند ساعت پس از قرار گرفتن در معرض ظاهر نشوند.
قرار گرفتن طولانی مدت (هشت ساعت) در معرض بخار اسید استیک با غلظت 10 پی پی ام می تواند باعث تحریک چشم، بینی و گلو شود.
در ppm 100 ممکن است باعث تحریک ریه مشخص شده و آسیب احتمالی به ریه ها، چشم ها و پوست شود.
غلظت بخار 1000 ppm باعث تحریک چشم ها، بینی و دستگاه تنفسی فوقانی می شود و قابل تحمل نیست.
این پیش بینی ها بر اساس آزمایش های حیوانی و قرار گرفتن در معرض صنعتی بود.
در 12 کارگری که به مدت دو سال یا بیشتر در معرض غلظت متوسط هوابرد اسید استیک 51 ppm (تخمین زده شده) قرار گرفتند، علائمی از تحریک اتصال دهنده، تحریک دستگاه تنفسی فوقانی و درماتیت هیپرکراتوتیک ایجاد شد. قرار گرفتن در معرض ppm 50 یا بیشتر برای اکثر افراد غیرقابل تحمل است و منجر به اشک ریزش و سوزش شدید چشم ها، بینی و گلو، همراه با ادم حلق و برونشیت مزمن می شود.
انسانهای سازگار نشده، سوزش شدید چشم و بینی را در غلظتهای بیش از 25 پیپیام تجربه میکنند، و ورم ملتحمه ناشی از غلظتهای کمتر از ppm 10 گزارش شده است.
در مطالعه ای بر روی پنج کارگر که به مدت 7 تا 12 سال در معرض غلظت 80 تا 200 پی پی ام در اوج قرار گرفتند، یافته های اصلی سیاه شدن و هیپرکراتوز پوست دست، ورم ملتحمه (اما بدون آسیب قرنیه)، برونشیت و فارنژیت، و فرسایش بود. دندان های در معرض دید (ثنایا و نیش).
اسید استیک غلیظ را میتوان به سختی در دما و فشار استاندارد مشتعل کرد، اما در دماهای بالاتر از 39 درجه سانتیگراد (102 درجه فارنهایت) به یک خطر اشتعال تبدیل میشود و میتواند با هوا در دماهای بالاتر مخلوطهای انفجاری تشکیل دهد ....
______________________________
_ محلول رقیق الکلی که با استوباکتر تلقیح شده و در مکانی گرم و هوا نگهداری شود، در طی چند ماه تبدیل به سرکه می شود.
روشهای تولید سرکه صنعتی با بهبود تامین اکسیژن به باکتریها، این فرآیند را تسریع میکنند.
اولین دستههای سرکه تولید شده از طریق تخمیر احتمالاً به دنبال اشتباهاتی در فرآیند شرابسازی بودند.
اگر باید در دمای خیلی بالا تخمیر شود، استوباکتر بر مخمر طبیعی موجود در انگور غلبه میکند.
با افزایش تقاضا برای سرکه برای مقاصد آشپزی، پزشکی و بهداشتی، باغداران به سرعت یاد گرفتند که از سایر مواد ارگانیک برای تولید سرکه در ماه های گرم تابستان قبل از رسیدن انگور و آماده شدن برای تبدیل شدن به شراب استفاده کنند.
با این حال، این روش کند بود و همیشه موفقیت آمیز نبود، زیرا تاک کاران این فرآیند را درک نمی کردند.
یکی از اولین فرآیندهای تجاری مدرن "روش سریع" یا "روش آلمانی" بود که برای اولین بار در سال 1823 در آلمان انجام شد.
در این فرآیند، تخمیر در برجی مملو از تراشه های چوب یا زغال چوب انجام می شود.
خوراک حاوی الکل به بالای برج چکانده میشود و هوای تازه از پایین با همرفت طبیعی یا اجباری تأمین میشود. بهبود عرضه هوا در این فرآیند زمان تهیه سرکه را از ماه ها به هفته ها کاهش داد.
_
با این حال، بیشتر استرهای استات از استالدئید با استفاده از واکنش تیشچنکو تولید میشوند.
علاوه بر این، استاتهای اتر به عنوان حلال برای نیتروسلولز، لاکهای اکریلیک، پاککننده لاک و لکههای چوب استفاده میشوند.
ابتدا مونو اترهای گلیکول از اکسید اتیلن یا پروپیلن اکسید با الکل تولید میشوند که سپس با اسید استیک استری میشوند. سه محصول اصلی عبارتند از اتیلن گلیکول مونو اتیل اتر استات (EEA)، اتیلن گلیکول مونوبوتیل اتر استات (EBA) و پروپیلن گلیکول مونو متیل اتر استات (PMA، که بیشتر به عنوان PGMEA در فرآیندهای تولید نیمه هادی شناخته می شود، جایی که به عنوان یک حلال مقاوم استفاده می شود. ).
این نرم افزار حدود 15 تا 20 درصد از اسید استیک در سراسر جهان را مصرف می کند.
استات های اتر، برای مثال EEA، برای تولید مثل انسان مضر هستند.
__ در حالی که اسید استیک رقیق شده در یونتوفورز استفاده میشود، هیچ شواهدی با کیفیت بالا از این درمان برای بیماری روتاتور کاف پشتیبانی نمیکند.
به عنوان درمانی برای اوتیت خارجی، در فهرست داروهای ضروری سازمان بهداشت جهانی قرار دارد.
اسید استیک 349 کیلوکالری (1460 کیلوژول) در هر 100 گرم دارد.
سرکه معمولاً کمتر از 4 درصد جرمی اسید استیک است.
محدودیت های قانونی در مورد محتوای اسید استیک بسته به حوزه قضایی متفاوت است.
سرکه مستقیماً به عنوان چاشنی و در ترشی سبزیجات و سایر غذاها استفاده می شود.
سرکه سفره معمولاً رقیقتر (4 تا 8 درصد اسید استیک) است، در حالی که ترشیهای غذایی تجاری از محلولهایی استفاده میکنند که غلیظتر هستند.
نسبت اسید استیک که در سرتاسر جهان به عنوان سرکه استفاده می شود به اندازه مصارف تجاری نیست، اما قدیمی ترین و شناخته شده ترین کاربرد است.
اسید استیک تحت واکنشهای شیمیایی معمول یک اسید کربوکسیلیک قرار میگیرد.
پس از درمان با پایه استاندارد، به استات فلزی و آب تبدیل میشود.
با بازهای قوی (مثلاً معرفهای ارگانولیتیوم)، میتوان آن را دوبرابر پروتون زدایی کرد و LiCH2COOLi ایجاد کرد. کاهش اسید استیک اتانول می دهد.
گروه OH محل اصلی واکنش است، همانطور که با تبدیل اسید استیک به استیل کلرید نشان داده شده است.
سایر مشتقات جایگزین عبارتند از انیدرید استیک. این انیدرید با از دست دادن آب از دو مولکول اسید استیک تولید می شود.
استرهای اسید استیک نیز میتوانند از طریق استریفیکیشن فیشر و آمیدها تشکیل شوند.
هنگامی که در دمای بالای 440 درجه سانتیگراد (824 درجه فارنهایت) گرم می شود، اسید استیک برای تولید دی اکسید کربن و متان یا تولید کتن و آب تجزیه می شود.
این فرآیند کاتیوای کاتالیز شده با ایریدیوم، سبزتر و کارآمدتر است و تا حد زیادی جایگزین فرآیند مونسانتو شده است، اغلب در همان کارخانههای تولید.
اسید استیک بین ستارهای در سال 1996 توسط تیمی به رهبری دیوید مهرینگر با استفاده از آرایه انجمن سابق برکلی-ایلینوی-مریلند در رصدخانه رادیویی هات کریک و آرایه میلیمتری سابق واقع در رصدخانه رادیویی دره اوونز کشف شد.
اولین بار در ابر مولکولی Sagittarius B2 North (همچنین به عنوان منبع Sgr B2 Large Molecule Heimat شناخته میشود) شناسایی شد.
اسید استیک اولین مولکولی است که در محیط بین ستاره ای تنها با استفاده از تداخل سنج های رادیویی کشف شد.
______________________________
_ _ در اسید استیک جامد، مولکولها زنجیرهها را تشکیل میدهند، مولکولهای جداگانه با پیوندهای هیدروژنی به هم متصل میشوند.
در بخار 120 درجه سانتیگراد (248 درجه فارنهایت)، دایمرها قابل شناسایی هستند.
دایمرها همچنین در فاز مایع در محلولهای رقیق در حلالهای غیر پیوندی هیدروژنی و تا حدی در اسید استیک خالص وجود دارند، اما توسط حلالهای پیوند هیدروژنی مختل میشوند. آنتالپی تفکیک دایمر 65.0-66.0 کیلوژول بر مول، و آنتروپی تفکیک در 154-157 J mol-1 K-1 برآورد شده است.
سایر اسیدهای کربوکسیلیک در تعاملات پیوند هیدروژنی بین مولکولی مشابه شرکت می کنند.
_خواص حلال
اسید استیک مایع یک حلال پروتیک آبدوست (قطبی) شبیه به اتانول و آب است.
با گذردهی نسبی استاتیک (ثابت دی الکتریک) 6.2، نه تنها ترکیبات قطبی مانند نمک های معدنی و قندها، بلکه ترکیبات غیر قطبی مانند روغن ها و همچنین املاح قطبی را نیز حل می کند.
با حلال های قطبی و غیر قطبی مانند آب، کلروفرم و هگزان قابل اختلاط است. با آلکانهای بالاتر (با اکتان شروع میشود)، اسید استیک در همه ترکیبها قابل اختلاط نیست و حلالیت اسید استیک در آلکانها با n-آلکانهای طولانیتر کاهش مییابد.
خواص حلال و امتزاج پذیری اسید استیک آن را به یک ماده شیمیایی صنعتی مفید تبدیل می کند، به عنوان مثال، به عنوان حلال در تولید دی متیل ترفتالات.
برخلاف اسیدهای کربوکسیلیک با زنجیره بلندتر (اسیدهای چرب)، اسید استیک در تری گلیسیریدهای طبیعی وجود ندارد.
با این حال، تری گلیسیرید مصنوعی تری استین (گلیسیرین تری استات) یک افزودنی رایج غذایی است و در لوازم آرایشی و داروهای موضعی یافت میشود.
_ اسید استیک توسط باکتریهای اسید استیک، بهویژه جنس استوباکتر و کلستریدیوم استوبوتیلیکوم تولید و دفع میشود.
این باکتریها به طور کلی در مواد غذایی، آب و خاک یافت میشوند و اسید استیک بهطور طبیعی با فاسد شدن میوهها و سایر غذاها تولید میشود.
اسید استیک همچنین جزئی از روانکاری واژن انسان و سایر پستانداران است، جایی که به نظر می رسد به عنوان یک عامل ضد باکتری خفیف عمل می کند.
اسید استیک به صورت صنعتی هم به صورت مصنوعی و هم از طریق تخمیر باکتریایی تولید می شود.
حدود 75 درصد از اسید استیک ساخته شده برای استفاده در صنایع شیمیایی توسط کربونیلاسیون متانول ساخته می شود که در زیر توضیح داده شده است.
مسیر بیولوژیکی تنها حدود 10 درصد از تولید جهانی را تشکیل می دهد، اما برای تولید سرکه همچنان مهم است، زیرا بسیاری از قوانین خلوص مواد غذایی، سرکه مورد استفاده در غذاها را ملزم می کنند که منشاء بیولوژیکی داشته باشد. فرآیندهای دیگر عبارتند از ایزومریزاسیون متیل فرمات، تبدیل گاز سنتز به اسید استیک و اکسیداسیون فاز گاز اتیلن و اتانول.
اسید استیک اغلب محصول جانبی واکنش های مختلف است، به عنوان مثال. در طول سنتز اسید اکریلیک کاتالیزوری ناهمگن یا تولید اسید لاکتیک تخمیری.
اسید استیک را می توان از طریق انجماد جزئی با استفاده از حمام یخ خالص کرد.
آب و سایر ناخالصیها مایع باقی میمانند در حالی که اسید استیک رسوب میکند.
از سال 2003 تا 2005، کل تولید جهانی اسید استیک بکر، 5 میلیون تن در هر سال (میلیون تن در سال) تخمین زده شد که تقریباً نیمی از آن در ایالات متحده تولید می شد. تولید اروپا تقریباً 1 میلیون تن در سال و رو به کاهش بود، در حالی که تولید ژاپن 0.7 میلیون تن در هر سال بود.
هر سال 1.5 میلیون تن دیگر بازیافت میشود و کل بازار جهانی را به 6.5 میلیون تن در هر سال میرساند.
از آن زمان تولید جهانی به 10.7 میلیون تن در هر سال (در سال 2010) افزایش یافته است.
با این حال، کاهش در این افزایش در تولید پیش بینی می شود.
دو بزرگترین تولید کننده اسید استیک بکر، Celanese و BP Chemicals هستند. سایر تولیدکنندگان عمده عبارتند از هزاره، شیمیایی استرلینگ، سامسونگ، ایستمن و اسونسک اتانولکمی.
_کربونیلاسیون متانول |
بیشتر اسید استیک از طریق کربنیلاسیون متانول تولید می شود.
در این فرآیند، متانول و مونوکسید کربن مطابق با معادله زیر واکنش نشان میدهند تا اسید استیک تولید کنند:
_ این فرآیند شامل یدومتان به عنوان یک واسطه است و در سه مرحله انجام میشود.
یک کاتالیزور، کربونیل فلز، برای کربونیلاسیون مورد نیاز است .
______________________________
_اکسیداسیون استالدهید |
قبل از تجاریسازی فرآیند مونسانتو، بیشتر اسید استیک از طریق اکسیداسیون استالدئید تولید میشد.
این روش دومین روش تولید مهم است، اگرچه معمولاً با کربونیلاسیون متانول قابل رقابت نیست.
استالدهید را می توان با هیدراتاسیون استیلن تولید کرد. این فناوری غالب در اوایل دهه 1900 بود.
اجزای نفتای سبک به آسانی توسط اکسیژن یا حتی هوا اکسید می شوند و پراکسیدهایی تولید می کنند که تجزیه می شوند و طبق معادله شیمیایی که با بوتان نشان داده شده است، اسید استیک تولید می کنند:
2 C4H10 + 5 O2 → 4 CH3CO2H + 2 H2O
چنین اکسیداسیونهایی به کاتالیزور فلزی مانند نمکهای نفتنات منگنز، کبالت و کروم نیاز دارند.
واکنش معمولی در دماها و فشارهایی انجام میشود که تا حد ممکن گرم باشد و در عین حال بوتان را مایع نگه دارد. شرایط واکنش معمولی 150 درجه سانتیگراد (302 درجه فارنهایت) و 55 اتمسفر است.
محصولات جانبی نیز ممکن است تشکیل شوند، از جمله بوتانون، اتیل استات، اسید فرمیک و اسید پروپیونیک.
این محصولات جانبی از نظر تجاری نیز ارزشمند هستند و شرایط واکنش ممکن است برای تولید بیشتر آنها در صورت نیاز تغییر یابد.
با این حال، جداسازی اسید استیک از این محصولات جانبی به هزینه این فرآیند میافزاید.
_ تحت شرایط مشابه و با استفاده از کاتالیزورهای مشابهی که برای اکسیداسیون بوتان استفاده میشود، اکسیژن موجود در هوا برای تولید اسید استیک میتواند استالدئید را اکسید کند.
2 CH3CHO + O2 → 2 CH3CO2H
با استفاده از کاتالیزورهای مدرن، این واکنش می تواند بازده اسید استیک بیش از 95٪ داشته باشد.
محصولات جانبی اصلی اتیل استات، اسید فرمیک و فرمالدئید هستند که همگی نقطه جوش پایینتری نسبت به اسید استیک دارند و به آسانی با تقطیر جدا میشوند.
_اکسیداسیون اتیلن
استالدئید ممکن است از اتیلن از طریق فرآیند واکر تهیه شود و سپس مانند بالا اکسید شود.
در زمانهای اخیر، شرکت شیمیایی Showa Denko، که در سال 1997 یک کارخانه اکسیداسیون اتیلن را در اویتا، ژاپن افتتاح کرد، تبدیل تک مرحلهای ارزانتر اتیلن به اسید استیک را تجاری کرد.
این فرآیند توسط یک کاتالیزور فلزی پالادیوم که روی یک اسید هتروپلی مانند اسید سیلیکوتنگستیک پشتیبانی میشود، کاتالیز میشود.
فرآیند مشابهی از همان کاتالیزور فلزی روی اسید سیلیکوتنگستیک و سیلیس استفاده میکند...
محلول رقیق الکلی که با استوباکتر تلقیح شده و در مکانی گرم و هوا نگهداری شود، در طی چند ماه تبدیل به سرکه می شود.
روشهای تولید سرکه صنعتی با بهبود تامین اکسیژن به باکتریها، این فرآیند را تسریع میکنند.
اولین دستههای سرکه تولید شده از طریق تخمیر احتمالاً به دنبال اشتباهاتی در فرآیند شرابسازی بودند.
اگر باید در دمای خیلی بالا تخمیر شود، استوباکتر بر مخمر طبیعی موجود در انگور غلبه میکند.
با افزایش تقاضا برای سرکه برای مقاصد آشپزی، پزشکی و بهداشتی، باغداران به سرعت یاد گرفتند که از سایر مواد ارگانیک برای تولید سرکه در ماه های گرم تابستان قبل از رسیدن انگور و آماده شدن برای تبدیل شدن به شراب استفاده کنند.
با این حال، این روش کند بود و همیشه موفقیت آمیز نبود، زیرا تاک کاران این فرآیند را درک نمی کردند.
یکی از اولین فرآیندهای تجاری مدرن "روش سریع" یا "روش آلمانی" بود که برای اولین بار در سال 1823 در آلمان انجام شد.
در این فرآیند، تخمیر در برجی مملو از تراشه های چوب یا زغال چوب انجام می شود.
خوراک حاوی الکل به بالای برج چکانده میشود و هوای تازه از پایین با همرفت طبیعی یا اجباری تأمین میشود. بهبود عرضه هوا در این فرآیند زمان تهیه سرکه را از ماه ها به هفته ها کاهش داد.
_ این توانایی کلستریدیوم برای متابولیسم مستقیم قندها یا تولید اسید استیک از ورودیهای کمهزینه، نشان میدهد که این باکتریها میتوانند اسید استیک را کارآمدتر از اکسیدکنندههای اتانول مانند استوباکتر تولید کنند.
با این حال، باکتریهای کلستریدیوم نسبت به استوباکتر نسبت به اسید مقاومتر هستند.
حتی مقاومترین سویههای کلستریدیوم میتوانند سرکه را در غلظتهای چند درصد تولید کنند، در مقایسه با سویههای استوباکتر که میتوانند در غلظتهای تا ۲۰ درصد سرکه تولید کنند.
در حال حاضر، تولید سرکه با استفاده از استوباکتر به جای استفاده از کلستریدیوم و تغلیظ آن مقرون به صرفهتر است. در نتیجه، اگرچه باکتریهای استوژن از سال 1940 شناخته شدهاند، اما استفاده صنعتی از آنها به چند کاربرد خاص محدود میشود.
[ اسید استیک ] یک معرف شیمیایی برای تولید ترکیبات شیمیایی است.
بزرگترین استفاده منفرد از اسید استیک در تولید مونومر وینیل استات است و پس از آن استیک انیدرید و استر تولید می شود.
حجم اسید استیک مورد استفاده در سرکه نسبتاً کم است...
______________________________
_ فرمولاسیون رایگان تولید سرکه به روش صنعتی
_ ارائه فرمول تولید سرکه کارخانه ای و روش تولید مرحله به مرحله
_ چگونه سرکه صنعتي با کیفیت بالا تولید کنیم؟
_ نحوه تولید اسید استیک و پروسه تولید آن
_ راه اندازی خط تولید سرکه به روش کارخانه ای
_ تجهيزات لازم جهت تولید اسید استیک صنعتي
_ آموزش تولید سرکه کارخانه ای با کیفیت، بدون دستگاه و به روش ساده
_ تهیه مواد اولیه جهت تولید سرکه سفید به روش صنعتی
_ آموزش آنلاين / مجوز تولید/ اداره صنایع / استاندارد / پشتیبانی / حداقل فضا / فضای لازم / تولید در منزل /مصالح ساختمانی / انواع شوینده خانگي / محصولات مراقبت خودرویی / مواد غذایی و نگهدارنده ها |
_ تولید محصولات آرايشي و بهداشتی با کیفیت بالا و صرفه اقتصادی
_ فرمول تولید اسیداستیک صفر تا صد با صرفه اقتصادی
_ نحوه استفاده از سرکه سیب و عملکرد آن
_ تولید سرکه کارخانه ای با کیفیت عالی
_ نحوه ترکیب مواد اولیه و درصد دقیق
_ نحوه سفارش مواد اوليه جهت تولید سرکه صنعتي
_ فرمول رایگان تولید سرکه به شیوه کارخانه
_ خاصیت هر کدام از مواد اولیه ساخت سرکه چیست؟
_ چگونگي تولید سرکه سفید با کيفيت بالا
_ آیا میتوان سرکه کارخانه ای را در منزل تولید کرد ؟
_ کسب و کار خانگی/ سود زیاد / بازار کار / فروش /
_ نحوه درست کردن اسیداستیک صنعتی چگونه است ؟
_ تولید سرکه سفید صنعتی با حداقل سرمايه
_ تولید سرکه کارخانه ای با کیفیت بالا
_ آموزش ساخت سرکه کارخانه ای باصرفه اقتصادی بالا
_ مراحل ساخت و تولید سرکه صنعتی
_ برای درست کردن اسیداستیک کارخانه ای به چه دستگاهی نیاز است ؟
_ آیا بدون دستگاه و تجهیزات میتوان سرکه به شیوه کارخونه ای درست کرد ؟
_قدرت ماندگاري سرکه به چه چیزی بستگی دارد؟
_ آیا سرکه صنعتی را میتوان بدون مجوز تولید نمود؟
_ چگونه برای تولیدی کارگاه مجوز دریافت کنیم؟
_ طرح توجيهي چیست ؟
فرمول رایگان ساخت سرکه به روش صنعتی |
فرمولاسیون رایگان ساخت آبلیمو به روش صنعتی
فرمولاسیون رایگان ساخت کلودیفایر/فرمول ابری کننده مایعات/کدر کننده آبلیمو